Trabalho apresentado por José de Alencar e Otávio A. Fiorentin no VIII Congresso Brasileiro de Soja. Goiânia – GO, Brasil. 2018.
A cultura da soja é conduzida no Brasil sob diferentes sistemas de cultivo, o que pode influenciar diretamente nas características químicas, físicas e biológicas da lavoura. O cultivo da oleaginosa cresce a cada safra, mesmo com a instabilidade dos fatores de produção.
A ocorrência de epidemias causadas por Sclerotinia sclerotiorum (Lib.) Barry (sin. Whetzelinia sclerotiorum) Korf e Dumont, agente causal do mofo branco, tem aumentado de forma preocupante no sul do país, particularmente em cultivo sob irrigação via pivô central e em área de semeadura direta (Menezes, 1995; Beruski, 2013).
O primeiro relato da doença no Brasil, ocorreu no ano de 1921, na cultura da batata (Chaves, 1964). Já a primeira descrição da doença na cultura da soja foi na década de 70, no estado do Paraná (Yamachita et al., 1978).
O fungo possui diversos hospedeiros comumente cultivados no Brasil, dentre eles a soja (Phaseolus vulgaris L.), canola (Brassica napus L. e Brassica rapa L.), girassol (Helianthus annus L.), tomate (Solanum lycopersicum L.) e ervilha (Pisum sativum L.). O patógeno também pode infectar plantas daninhas, como o picão (Bidens spp.), caruru (Amaranthus spp.) e vassoura (Baccharis spp.).
Os primeiros sintomas do mofo-branco surgem no ponto de inserção dos pecíolos ou na base das ramificações da haste. Posteriormente, com a colonização do fungo, são observadas áreas descoloridas de cor parda à parda-avermelhada. Os primeiros sinais surgem na forma de uma massa de micélio branco, de aspecto cotonoso nas hastes, ramos e vagens das plantas infectadas. Com a evolução da doença, surgem por entre o micélio estruturas macroscópicas negras, rígidas e de forma variável, chamadas de escleródios (Chamberlain, 1973).
Com a murcha e morte das partes superiores ao ponto de infecção, há um decréscimo na qualidade e na quantidade dos grãos produzidos.
O risco de infecção é menor em cultivares de ciclo curto e com resistência ao acamamento (Hoffman et al., 1998). A época de floração e a arquitetura da planta geram diferentes severidades da doença (Bolland & Hall, 1987; Kim & Diers, 2000). Apesar da variabilidade genética de cultivares já relatada no Brasil (Garcia et al, 2012) não existem cultivares imunes ao mofo branco devido à resistência genética ser quantitativa, com moderada a baixa herdabilidade (Milklas, 2001; Pascual, 2010).
O sistema de cultivo está diretamente ligado ao manejo dos restos culturais. No sistema de semeadura direta toda a palhada permanece sobre o solo, podendo criar condições favoráveis à multiplicação e a sobrevivência de patógenos necrotróficos (Reis et al., 2011a).
O cultivo de soja e espécies vegetais anuais de folhas largas na mesma área por vários anos, favorece o aumento do inóculo de patógenos necrotróficos, incluíndo S. sclerotiorum (Reis & Casa, 2012). Apesar disto a lucratividade e a liquidez dos grãos da oleaginosa são os principais motivos para o produtor optar pela monocultura.
Visando fomentar as informações a respeito da intensidade do mofo branco, este trabalho teve por objetivo avaliar a incidência da doença em lavouras comerciais do cultivar de soja BMX Ativa no município de Lagoa Vermelha, em sistema de semeadura direta em rotação a milho ou monocultura de soja.
As lavouras vistoriadas foram semeadas no primeiro decêndio de novembro de 2017. Os tratos culturais foram realizados conforme critério de cada produtor. No período de 26/02/2018 à 9/03/2018 as lavouras foram semeadas. Neste período, as plantas estavam em R5.3 (25% – 50% de enchimento) à R5.5 (75% – 100% de enchimento).
A incidência de mofo branco (%) foi quantificada contando-se o número total de plantas (média de 11 pl m-1) e o número total de plantas com sintomas ou sinais da doença em cinco repetições de 10 m-1, totalizando em média 550 plantas avaliadas em cada lavoura.
Os valores de incidência foram transformados para para satisfazer as pressuposições do modelo estatístico. Após a Análise de Variância, foi utilizado o teste de comparações múltiplas de Tukey (p≤0,01) para comparar os dois sistemas de cultivo quanto a incidência de mofo branco. O Coeficiente de variação CV (%) foi igual á 36%, sendo um valor aceitável para levantamento de campo.
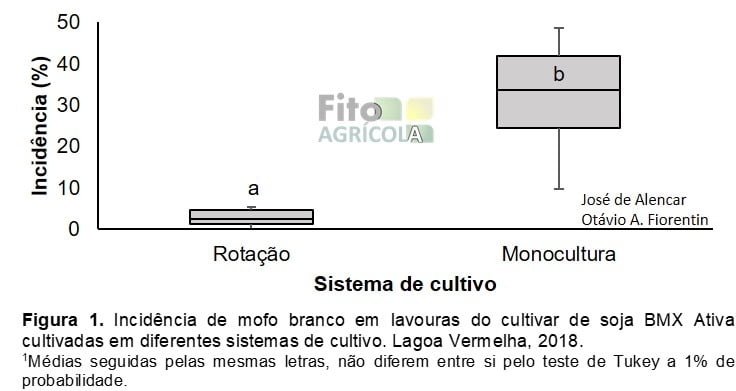
A incidência de mofo branco nas lavouras conduzidas em rotação com milho variou de 0 % até 15 %, com média de 4 %. Diferindo estatisticamente da incidência em monocultura de soja, que foi de 31%, com variação de 10 % até 49 % (Figura 1).
Nas lavouras visitadas neste levantamento, a ocorrência de mofo branco foi de 100% nas lavouras conduzidas em monocultura de soja, e 90% nas lavouras conduzidas em rotação com milho.
A menor incidência de mofo branco em lavouras conduzidas em rotação de cultura pode ser explicada pela redução da fonte de inóculo. A longevidade de escleródios de S. sclerotiorum na superfície do solo é de aproximadamente 12 meses, devido às condições edafoclimáticas da Região Sul do Brasil, fazendo com que a rotação de culturas com espécies vegetais não suscetíveis reduza o banco de escleródios no solo e consequentemente a incidência de mofo branco na próxima safra (BRUSTOLIN et al., 2016). Em estudo sobre a influência da rotação de culturas na produção de apotécios de S. sclerotiorum em escleródios, Gracia-Garza et al., (2002) relataram uma redução de 47% a 80% no número de apotécios formados, corroborando com os dados obtidos neste trabalho.
A relação entre o rendimento de grãos e a incidência do mofo-branco em plantas de soja determina a função média de dano da doença. No Brasil, esta equação é expressa por R = 1.000 – 6,7 I (REIS et al., 2011b). Com auxílio desta equação é obtido dano de 26,8 kg ha-1 (2,7 %) em áreas de rotação com milho e 207,7 kg ha-1 (20,8 %) em áreas de monocultura para cada 1.000 kg ha-1 de expectativa no rendimento de grãos. O que representa 87 % de redução no dano pela prática da rotação de cultura com milho.
Dados de Cardoso (1994) mostram que nos estados de São Paulo, Minas Gerais e Goiás, o dano causado pelo mofo branco pode chegar até 50%. Neste trabalho a lavoura com maior incidência da doença (49 %) resultou em 33 % de dano no rendimento de grãos segundo a equação de Reis et al. (2011b).
Diante das informações e dados apresentados, podemos concluir que a rotação de soja com milho reduz a incidência de mofo branco e consequentemente o dano causado pela doença.
Referências
BOLAND, G.J.; HALL, R. Epidemiology of white mold of white bean in Ontario. Canadian Journal of Plant Pathology, v. 9, p. 218-224, 1987.
BRUSTOLIN, R.; REIS, R.M.; PEDRON, L. Longevity of Sclerotinia scleroriorum on the soil surface under field conditions. Summa Phytopathologica, v. 42, n. 2, p. 172-174, 2016.
CARDOSO, J.E. Mofo-branco. In: Principais doenças do feijoeiro comum e seu controle. Brasília: EMBRAPA – SPI, 1994. p. 111-122. (EMBRAPA-CNPAF. Documentos online, n. 50).
CHAMBERLAIN, D.W. Soybean diseases in Illinois. Urbana, University of Illinois, 1973. p. 9-10 (Circular, n. 1085).
CHAVES, G.M. Estudos sobre Sclerotinia sclerotiorum (lib) de Bary. Experientiae, v. 4, p. 69-133, 1964.
GARCIA-GARZA, J.A.; BOLAND, G.J.; VYN, T.J. Influence of crop rotation and reduced tillage on white mold of soybean caused by Sclerotinia sclerotiorum. Can. J. Plant Pathology, v. 24, p.115-121, 2002.
GARCIA, R.A.; JULIATTI, F.C. Avaliação da resistência da soja a Sclerotinia sclerotiorum em diferentes estádios fenológicos e períodos de esposição ao inóculo. Tropical Plant Pathology, v.73, p. 196-203, 2012.
HOFFMAN, D.D.; HARTMAN, G.L.; MUELLER, D.M.; LEITZ, R.A.; NICKELL, C.D.; PEDERSEN, W.L. Yield and seed quality of soybean cultivars infected with Sclerotinia sclerotiorum. Plant Disease, v. 82, p. 826-829, 1998.
KIM, H.S.; DIERS, B.W. Inheritance of partial resistance to sclerotinia stem rot in soybean. Crop Science, v. 40, p. 55-61, 2000.
MENEZES, J.R. Controle integrado das doenças do feijoeiro comum irrigado por pivô central. Summa Phytopathologica, v. 21, p. 65-66, 1995.
MILKLAS, P.N. QTL conditioning physiological resistance and avoidance to White mold dru bean. Crop Science, v. 41, p. 309-315, 2001.
PASCUAL, A.; CAMPA, A.; PEREZ-VEGA, E. Screening common bean for resistance to four Sclerotinia sclerotiorum isolates collected in Northern Spain. Plant Disease, v. 94, p. 885-890, 2010.
REIS, E. M.; CASA, R. T. Doenças da Soja: Etiologia, sintomatologia, diagnose e manejo integrado. Passo Fundo- RS: Berthier, p. 434. 2012.
REIS, E. M.; TOMAZINI, S.L. Viabilidade de escleródios de Sclerotinia sclerotiorum, no campo, em duas profundidades do solo. Summa Phytopathologica. v. 31, n. 1, p. 97-99, 2005.
REIS E.M.; BARUFFI, D.; REMOR, L; ZANATTA, M. Decomposition of corn and soybean residues under field conditions and their role as inoculum source. Summa Phytopathologica, v. 37, n.1, p. 65-67, 2011b.
REIS, E.M.; BRUSTOLIN, R.; DANELLI, A.D.; CASA, R.T. Ciclo do mofo branco. Revista Plantio Direto, v. 122, p. 24-27, 2011a.
JULIATTI, F.C.; SAGATA, E.; JACCOUD FILHO, D.S.; JULIATTI, B.C.M. métodos de inoculação e avaliação da resistência de genótipos de soja à Sclerotinia sclerotiorum. Biosci. J., v. 30, n. 4, p. 958-968, 2014.
GARCIA, R.A.; MEYER, M.C.; ÁVILA, K.A.G.B.; CUNHA, M.G.Métodos de inoculação de Sclerotinia sclerotiorum para triagem de cultivares de soja resistentes ao mofo‑branco. Pesquisa Agropecuária Brasileira, v. 50, n. 8, p. 726-729, 2015.
YAMASHITA, J.; NASSER, L.; ALMEIDA, A.M.R.; MACHADO, C.C.; FERREIRA, L.P. Ocorrência da fase perfeita do fungo Wherzelinia sclerotiorum (Lib.) Korf & Dumont, em lavouras de soja no Estado do Paraná. Fitopatologia Brasileira, v.3, p. 109, 1978.
